傳遞遺傳信息到體內(nèi)目標(biāo)細(xì)胞內(nèi)部一直是基因治療面臨的主要挑戰(zhàn)。這一障礙現(xiàn)在正在被克服��,近年來����,基于脂質(zhì)的系統(tǒng),特別是脂質(zhì)納米粒子(LNPs)��,在實(shí)現(xiàn)核酸疫苗和治療劑的遞送方面取得了顯著進(jìn)展���。
傳遞遺傳信息到體內(nèi)目標(biāo)細(xì)胞內(nèi)部一直是基因治療面臨的主要挑戰(zhàn)�����。這一障礙現(xiàn)在正在被克服,近年來�����,基于脂質(zhì)的系統(tǒng)���,特別是脂質(zhì)納米粒子(LNPs)��,在實(shí)現(xiàn)核酸疫苗和治療劑的遞送方面取得了顯著進(jìn)展�����。在這里我們基于脂質(zhì)納米粒子(LNPs)在核酸遞送中60年發(fā)展歷程�����,詳細(xì)介紹了脂質(zhì)體和脂質(zhì)復(fù)合物的發(fā)展�、脂質(zhì)納米粒子遞送系統(tǒng)的開發(fā)以及未來的展望。
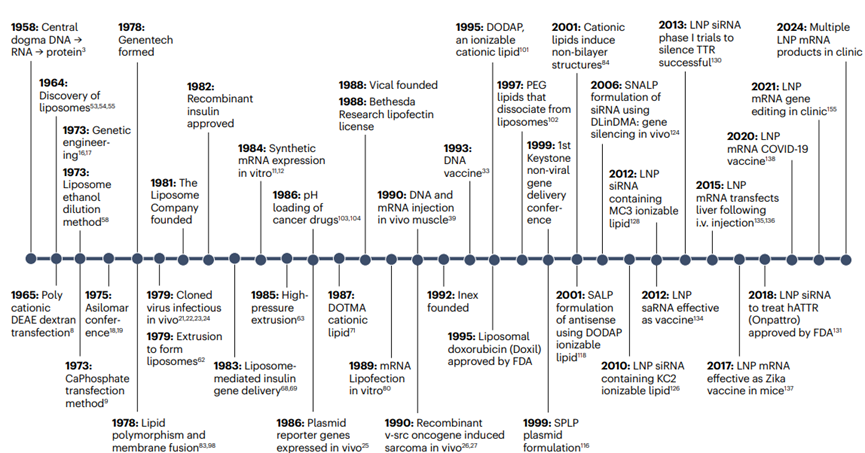
圖1.導(dǎo)致lnp激活RNA疫苗和療法的事件時(shí)間表
1958年���,分子生物學(xué)的中心法則被提出����,即DNA到RNA再到蛋白質(zhì)的信息流���,這為后續(xù)的基因治療和RNA疫苗的發(fā)展奠定了理論基礎(chǔ)�����;1964年到1973年期間�,脂質(zhì)體(liposomes)和鈣-磷酸鹽-DNA共沉淀法被發(fā)現(xiàn)�,這為后續(xù)的LNP技術(shù)提供了技術(shù)原型;1981年��,病毒載體進(jìn)行基因治療的概念被提出,這一概念對后續(xù)LNP技術(shù)的發(fā)展產(chǎn)生重要影響�����;1984年��,重組痘苗病毒的開發(fā)為RNA疫苗的發(fā)展提供了參考�����;1989年����,一些非病毒方法被用于疫苗開發(fā);1990年代中期����,LNP技術(shù)發(fā)展進(jìn)入關(guān)鍵時(shí)期��,Inex Pharmaceuticals和UBC開始合作研究����,開發(fā)基于脂質(zhì)的核酸遞送系統(tǒng);1995年到1999年期間����,LNP技術(shù)中關(guān)鍵的脂質(zhì)成分離子化的可電離陽離子脂質(zhì)DODAP穩(wěn)定質(zhì)粒脂質(zhì)體(SPLP)被開發(fā)����,標(biāo)志著LNP技術(shù)進(jìn)入新階段�����。2001年到2012年期間���,穩(wěn)定反義脂質(zhì)體(SALP)��、穩(wěn)定核酸脂質(zhì)體(SNALP)配方和LNP siRNA相繼被開發(fā)出來���,使得LNP技術(shù)得到了進(jìn)一步發(fā)展;2015年到2024年期間����,LNP技術(shù)在mRNA遞送方面的發(fā)展及應(yīng)用,標(biāo)志著LNP技術(shù)在疫苗領(lǐng)域的成功應(yīng)用(圖1)�。LNP技術(shù)從早期的脂質(zhì)體研究到現(xiàn)代RNA疫苗和療法的60年的發(fā)展歷程,每一步都為最終的成功應(yīng)用奠定了基礎(chǔ)��。
脂質(zhì)體是在水中分散的脂質(zhì)形成的多層囊泡���,通常由一個(gè)或多個(gè)脂質(zhì)雙層組成�,這些雙層圍繞一個(gè)或多個(gè)水性腔室。脂質(zhì)雙層由兩排磷脂分子組成���,其中磷脂的親水性頭部朝向水相����,而疏水性尾部相互面對�����,形成穩(wěn)定的結(jié)構(gòu)�。同時(shí),為了提高脂質(zhì)體的循環(huán)時(shí)間和靶向性�����,脂質(zhì)體表面可以修飾聚乙二醇(PEG)等聚合物���,以減少免疫系統(tǒng)的識別和清除。由于脂質(zhì)體可以通過內(nèi)吞作用進(jìn)入細(xì)胞���,隨后在內(nèi)體或溶酶體中與膜融合����,釋放其包裹的內(nèi)容物。因此脂質(zhì)體可以作為藥物和基因治療劑的載體��。脂質(zhì)體在藥物遞送和基因治療中起關(guān)鍵作用���,脂質(zhì)體的穩(wěn)定性�����、循環(huán)特性����、細(xì)胞攝取效率都會對最終的治療效果產(chǎn)生極大影響�。
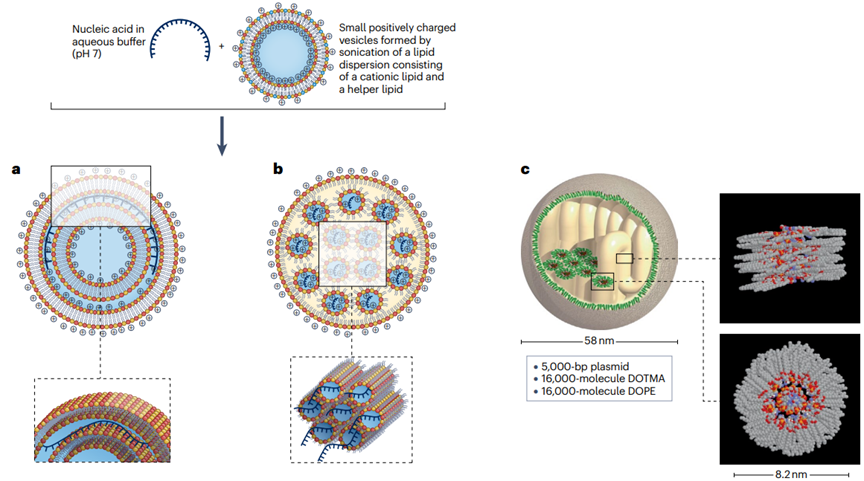
圖2.脂質(zhì)體的形成和結(jié)構(gòu)
LNP的形成是一個(gè)復(fù)雜的過程,涉及精確的化學(xué)和物理操作�����,以確保核酸的有效包裹和遞送�����。這些顆粒的設(shè)計(jì)允許它們在體內(nèi)循環(huán)���,特異性地靶向和進(jìn)入細(xì)胞�,最終釋放其核酸貨物,用于疫苗開發(fā)�����、基因治療和其他治療應(yīng)用�����。LNP由四種主要脂質(zhì)成分組成����,包括可電離脂質(zhì)(或陽離子脂質(zhì))、輔助脂質(zhì)����、膽固醇和聚乙二醇化脂質(zhì)(PEG-脂質(zhì))。這些脂質(zhì)首先在有機(jī)溶劑(如乙醇)中溶解����,形成均勻的脂質(zhì)溶液;之后將含有核酸(如mRNA)的水相溶液與脂質(zhì)的有機(jī)相溶液快速混合����。在混合過程中,可電離脂質(zhì)在水相中質(zhì)子化�����,帶正電荷�����,與帶負(fù)電荷的核酸磷酸骨架發(fā)生靜電結(jié)合���。然后在混合后的溶液中�����,脂質(zhì)成分由于疏水作用和范德華力相互作用�,自發(fā)組織成納米結(jié)構(gòu)實(shí)體��。這一過程中���,脂質(zhì)成分圍繞核酸形成多層囊泡或納米結(jié)構(gòu)核心�����。再然后通過改變PEG-脂質(zhì)的量或混合參數(shù)(如流速和體積比)�,調(diào)節(jié)LNP的大小和均勻性。此外�����,通過透析或切向流過濾提高pH值�����,中和可電離脂質(zhì)���,形成不帶電的納米脂質(zhì)顆粒�。最后通過擠壓����、透析和過濾消毒等后處理步驟,以確保LNP的均勻性��、穩(wěn)定性�,并去除未封裝的貨物和多余的脂質(zhì)成分(圖3)。LNP的形成過程對其最終的物理化學(xué)性質(zhì)和生物分布具有重要影響�。例如,LNP的大小���、表面電荷(Zeta電位)���、包封效率和顆粒濃度等特性��,都會影響其在體內(nèi)的藥代動力學(xué)和藥效學(xué)行為。因此���,優(yōu)化LNP的制備方法和配方組成�,對于提高核酸藥物的遞送效率和治療效果至關(guān)重要��。
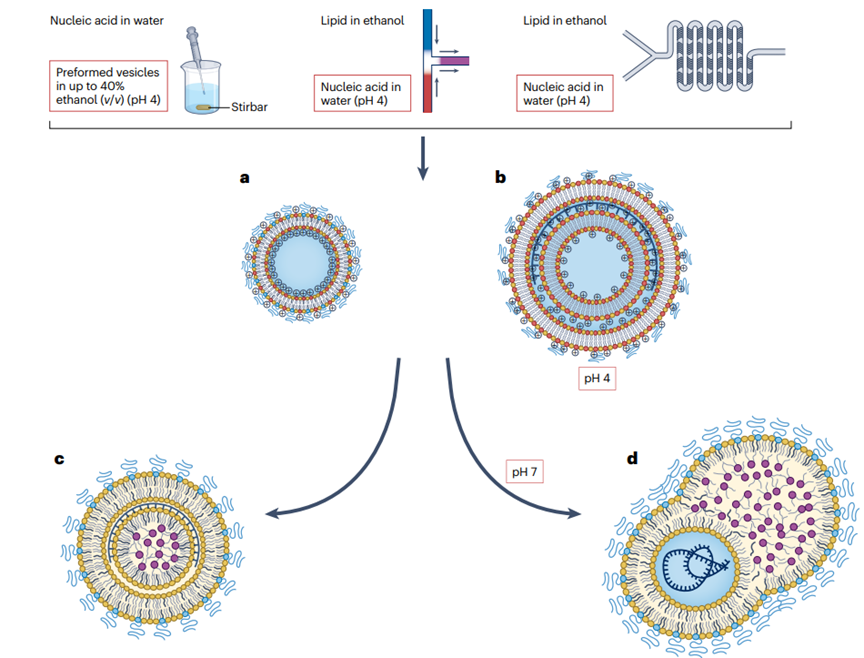
圖3.脂質(zhì)納米顆粒的形成
LNP mRNA傳遞系統(tǒng)的作用機(jī)制
脂質(zhì)納米粒(LNP)作為mRNA的傳遞系統(tǒng)��,其作用機(jī)制涉及多個(gè)步驟�����,確保mRNA安全有效地遞送到目標(biāo)細(xì)胞并表達(dá)蛋白�。首先LNP的脂質(zhì)外殼可以保護(hù)mRNA免受外界環(huán)境(如血液、組織液)中核酸酶的降解�����,確保mRNA的穩(wěn)定性��。LNPs會通過受體介導(dǎo)的內(nèi)吞作用被細(xì)胞攝取,LNP被細(xì)胞攝取后��,會進(jìn)入內(nèi)涵體��?����?呻婋x脂質(zhì)在內(nèi)涵體的酸性環(huán)境中質(zhì)子化����,帶正電荷,這有助于破壞內(nèi)涵體膜����,使LNP能夠逃逸到細(xì)胞質(zhì)中。內(nèi)涵體逃逸后��,mRNA從LNP中釋放出來�,進(jìn)入細(xì)胞質(zhì)。釋放的mRNA在細(xì)胞質(zhì)中被核糖體識別并翻譯成相應(yīng)的蛋白質(zhì)�。翻譯后的蛋白質(zhì)在細(xì)胞內(nèi)或分泌到細(xì)胞外,發(fā)揮其生物學(xué)功能��。LNP的脂質(zhì)成分在完成遞送任務(wù)后��,會在細(xì)胞內(nèi)逐漸被生物降解,釋放出的成分可以被細(xì)胞再利用或排出體外(圖4)�。基于這一作用機(jī)制LNPs在保護(hù)mRNA��、促進(jìn)細(xì)胞內(nèi)傳遞���、以及激活免疫反應(yīng)方面發(fā)揮關(guān)鍵作用����。
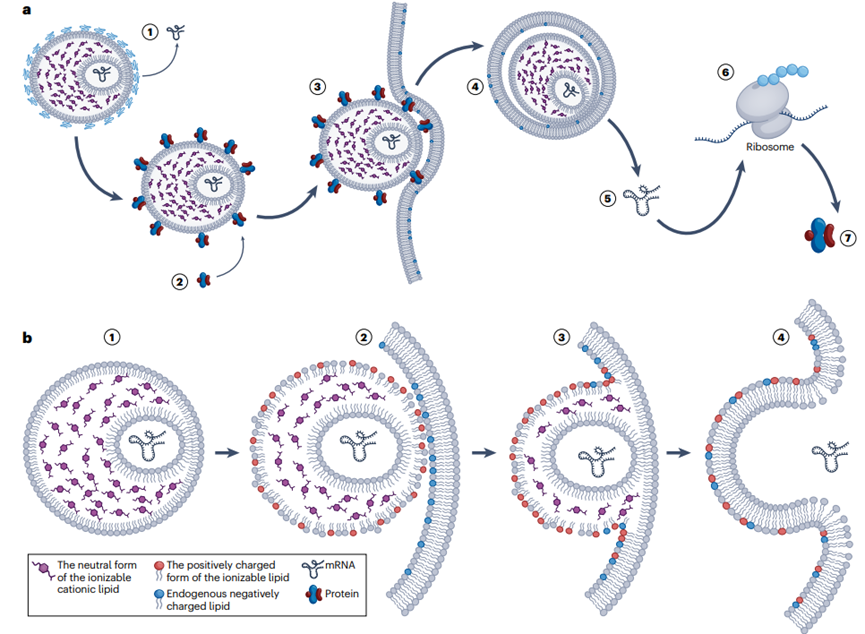
圖4.LNP mRNA傳遞系統(tǒng)的作用機(jī)制
當(dāng)前LNP技術(shù)的應(yīng)用
脂質(zhì)納米粒(LNP)技術(shù)作為一種先進(jìn)的藥物遞送系統(tǒng)��,已經(jīng)在多個(gè)領(lǐng)域顯示出其廣泛的應(yīng)用潛力����。LNP技術(shù)在COVID-19 mRNA疫苗的開發(fā)中發(fā)揮了關(guān)鍵作用�����,成功實(shí)現(xiàn)了mRNA的高效遞送至人體細(xì)胞內(nèi)��,激發(fā)免疫反應(yīng)����,目前有60多種使用LNP遞送技術(shù)的疫苗和治療劑已經(jīng)獲得批準(zhǔn)或正在進(jìn)行臨床開發(fā)��,其中30種已經(jīng)進(jìn)展到超過第一階段的臨床試驗(yàn)(圖5)�。此外運(yùn)用LNP來封裝siRNA或mRNA����,可以實(shí)現(xiàn)對腫瘤組織的靶向性藥物遞送,從而實(shí)現(xiàn)對癌癥的治療��。通過將Cas9 mRNA和sgRNA封裝在LNP中�,也可實(shí)現(xiàn)對特定基因的精確編輯。LNP也能夠作為蛋白質(zhì)替代療法遞送編碼治療性蛋白的mRNA�,用于治療由蛋白質(zhì)缺陷引起的遺傳性疾病。針對一些罕見遺傳病�,LNP技術(shù)可以封裝特定的基因編輯組件或治療性mRNA,為這些疾病提供潛在的治療方案等��。LNP技術(shù)的多功能性和適應(yīng)性使其在生物醫(yī)學(xué)領(lǐng)域具有廣泛的應(yīng)用前景��,隨著研究的深入和技術(shù)的優(yōu)化��,預(yù)計(jì)將有更多的基于LNP遞送的核酸藥物上市�,為多種疾病提供新的治療策略。
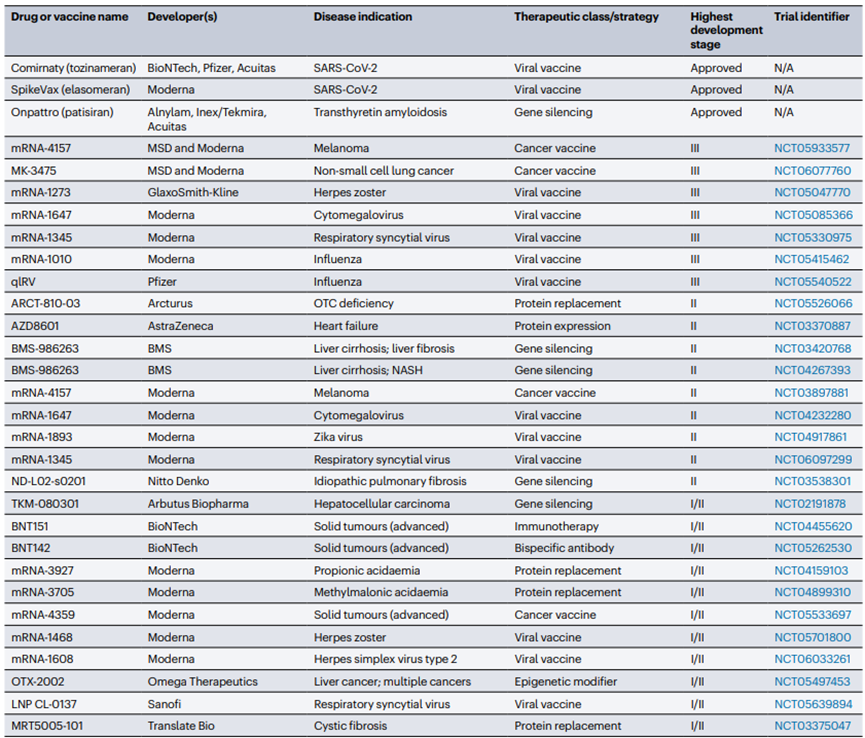
圖5.選定的lnp激活RNA疫苗和治療方法已超過I期臨床開發(fā)
寫在最后
總的來說��,基于LNP的系統(tǒng)在核酸疫苗和治療劑遞送方面的顯著成功正在引領(lǐng)新一代基因治療的到來�����。這些系統(tǒng)在遺傳容量、重新劑量能力�、可擴(kuò)展性、制造簡易性����、成本低廉以及開發(fā)高度個(gè)性化的靶向治療方面,展現(xiàn)出了超越病毒和其他遞送系統(tǒng)的壓倒性優(yōu)勢����。基于LNP遞送系統(tǒng)啟用的基因治療的未來前景顯然是變革性的�。
參考文獻(xiàn):
The 60-year evolution of lipid nanoparticles for nucleic acid delivery













![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號-57
2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號-57